Методы определения активности протеолитических ферментов
Модификационный метод. Модификационный метод с применением субстрата казеина основан на определении скорости ферментативной реакции гидролиза субстрата под действием исследуемых протеолитических ферментов, содержащихся в материале, взятом на анализ. Скорость реакции определяют по количеству образовавшихся аминокислот - тирозина (a-амино-b-оксифенилпропионовая кислота) и триптофана (a-амино-b-индолилпропионовая кислота), которые устанавливают колориметрической реакцией с реактивом Фолина. Этим методом определяют указанные аминокислоты как в свободном, так и в связанном состоянии.
По количеству тирозина и триптофана, содержащемуся в гидролизате, определяют количество превращенного белка в процессе ферментативной реакции (из расчета содержания в белке 6% тирозина и 1.8% триптофана). В основу расчета активности протеолитических ферментов положена зависимость степени гидролиза белка от числа единиц активности фермента, введенных в ферментативную реакцию. На основе этой зависимости составляется график.
Поскольку в данном методе количество аминокислот, характеризующих количество превращаемого белка, определяется по интенсивности окраски реакционных сред - оптической плотности после реакции с реактивом, то в графике для простоты расчета вместо количества превращенного белка ставится пропорциональная ему оптическая плотность раствора. При составлении графика по оси абсцисс откладывают число единиц фермента, введенное в ферментативную реакцию, а по оси ординат - оптическую плотность, полученную после колориметрической реакции с реактивом Фолина.
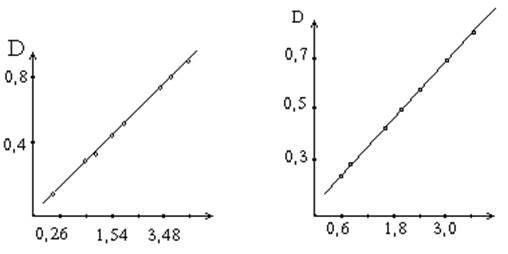
а) Содержание белка,мг б) Единицы активности
а) Зависимость оптической плотности от количества превращенного в процессе ферментативной реакции белка.
б) Зависимость оптической плотности от числа единиц активности протеолитических ферментов.
Относя количество введенных в реакцию единиц активности фермента к действию 1 г препарата, определяют его активность. Для расчета прямой, изображенной на графике, составляет расчетное уравнение.
За единицу протеолитической активности принято такое количество фермента, которое катализирует за 30 минут гидролиз 1 г белка в принятых условиях до продуктов, не осаждающихся трихлоруксусной кислотой. 1г составляет 25% от взятого на ферментативную реакцию белка.
Протеолитическая активность характеризуется числом единиц активности фермента, содержащегося в 1 г препарата и твердых полупродуктов или в 100 мл жидких материалов. Метод предназначен для анализа очищенных ферментных препаратов грибного происхождения и всех полупродуктов, получающихся при их производстве.
Определение пепсина по Ансону и Мирскому. Данный метод основан на следующих принципах. Гемоглобин подвергают воздействию пепсина, оставшийся гемоглобин осаждают трихлоруксусной кислотой. Фенольные свойства остатка (тирозин), определяемые фотометрически, используют как меру активности фермента.
Субстратом служит 2%-ный раствор гемоглобина в 0.06 н. растворе соляной кислоты, 5 мл субстрата нагревают до 250С, прибавляют 1 мл раствора фермента, оставляют в течении 10 мин., добавляют 10 мл 0.3 н. раствора трихлоруксусной кислоты, энергично взбалтывают, фильтруют и 5 мл фильтрата отливают в мерную колбу на 25 мл. Сюда же приливают 10 мл 0.5 н. раствора едкого натра и 3 мл фенольного реактива (реактив Фолина-Чиокалтеу разводят предварительно двойным объемом воды) и доводят водой до метки. По истечении нескольких минут окрашенный раствор фотометрируют относительно стандартного раствора, содержащего 0.0008 мэкв тирозина в 5 мл 0.2 н. раствора соляной кислоты (к раствору добавляют 0.5% формальдегида в качестве антисептика). Для исключения возможных ошибок ставят холостой опыт. Единицы пепсина выражают в миллиэквивалентах тирозина (в пределах от 6.10-4 до 11.10-4): единицы пепсина = миллиэквиваленты тирозина х1.47.
Определение протеолитических ферментов по Муру и Штейну. Метод основан на том, что содержащие a-аминогруппу аминокислоты дают с нингидридом окрашенную производную - дикетогидриндилидендикетогидриндамин, а также альдегид-аминокислоты и углекислоту.
Окрашенный продукт обладает характерным максимумом поглощения при 570 мm, а интенсивность окраски зависит от количества аминокислоты. С пролином и оксипиролином реакция протекает в ином направлении, а максимум поглощения получаемого при этом окрашенного продукта расположен при 440 мm.
Инкубацию фермента удобно проводить в мерных колбочках по 5 мл, в которых смешивают и уравновешивают при постоянной температуре на водяной бане все компоненты за исключением фермента. После этого добавляют фермент, раствор смешивают и берут пробы для исследования. Для кинетических измерений концентрацию фермента желательно подобрать таким образом, чтобы аликвотные части можно было бы брать каждые 5 минут.
Другое
Многоплодная беременность. Патология околоплодной среды
Цель
занятия: изучить этиологию, диагностику, особенности течения
многоплодной беременно, особенности развития плодов, особенности течения и ...
Лекции по анатомии
Ангиология – это наука о сосудах (от
греч. angion – сосуд, logos – учение)
Кровеносная
система ...
Физическая подготовка иностранных армий
Велик
мир, и много в нем больших и малых государств. Каждое государство должно иметь
свою армию. Эта армия защищает интересы государства, к ...
Особенности уролитиаза собак и кошек в условиях мегаполиса (распространение, этиология, патогенез.)
ОБШАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. В структуре заболеваемости кошек и собак патология мочевыводящей
системы по частот ...